Хронические заболевания почек представляют собой серьезную проблему здравоохранения. Это определяется как неуклонным ростом числа больных с хронической почечной недостаточностью, так и высокой стоимостью и относительно неудовлетворительными исходами их лечения [1]. Анализ Базы данных пациентов с заболеваниями почек (USRDS) и результатов исследования NHANES III в США показал, что около 26 млн взрослых, то есть примерно 14,6% от числа населения старше 20 лет, страдают хроническими заболеваниями почек [4]. За последние пять лет число больных, находящихся на заместительной почечной терапии, увеличилось более чем на 25% и на данный момент составляет более 2 млн человек. При этом наибольшее количество больных, получающих заместительную почечную терапию, зарегистрировано в Японии (2230 пациентов на 1 млн жителей) и в США (1650 больных на 1 млн жителей). Наибольший рост числа таких пациентов зафиксирован в развивающихся странах (в том числе в России) — свыше 50% за 5 лет [6].
Исходя из данных о весьма значительной распространенности хронических заболеваний почек и динамике прироста терминальной стадии хронической почечной недостаточности в течение последних 20 лет эксперты прогнозируют и в будущем дальнейший рост численности этой категории больных, тем более что, благодаря значительному техническому прогрессу, заместительная почечная терапия в настоящее время может применяться практически без ограничений [4].
Проблема лечения терминальной стадии хронической почечной недостаточности усугубляется тем, что, несмотря на значительный прогресс в заместительной почечной терапии, ее прогноз все еще остается весьма неблагоприятным. В США сохраняется высокая годичная летальность пациентов, находящихся на заместительной почечной терапии, — более 20%. Ожидаемая продолжительность их жизни значительно короче, чем в сходной возрастной группе. Так, для пациентов в возрасте от 40 до 44 лет она составляет 7,1–11,5 года, а для пациентов от 60 до 64 лет — 2,7–3,9 года. Частота сопутствующих заболеваний у больных с хроническими заболеваниями почек также высока. Их среднее количество у больного, находящегося на заместительной почечной терапии, равно четырем, и основную роль при этом играют заболевания сердечно-сосудистой системы [22].
Пациенты с хроническими заболеваниями почек имеют большую вероятность умереть от осложнений своего заболевания, чем дожить до потребности в диализе. Летальность вследствие заболеваний сердца среди пациентов с терминальной стадией хронической почечной недостаточности в 10 раз выше, чем в общей популяции. Например, по данным американского регистра 2002 года у больных с почечной недостаточностью в 24,8% случаев выявлена ишемическая болезнь сердца, а в 8,7% — инфаркт миокарда [29]. У пожилых пациентов с хронической почечной недостаточностью частота ишемической болезни сердца выше на 22%, латентной ишемии — на 16%, а новых коронарных событий — в 3,4 раза по сравнению с пациентами без нарушения функции почек [6]. По данным исследования HOPE легкая почечная недостаточность (креатинин плазмы 124–200 мкмоль/л), независимо от других факторов риска и лечения, ассоциировалась с увеличением сердечно-сосудистой смертности от инфаркта миокарда и инсульта на 40% [25].
Предметом интереса недавних исследований стал вопрос, в какой мере сопутствующие сердечно-сосудистые заболевания могут быть связаны с нарушениями функции паращитовидных желез, развивающимися параллельно со снижением функции почек. Концепция, в соответствии с которой воздействие на рецепторы, подобные рецепторам паращитовидных желез, обнаруженные во многих органах и тканях, могут играть определенную роль в развитии и прогрессировании сердечно-сосудистых заболеваний у пациентов с хроническими заболеваниями почек, является относительно новой [2].
Вторичный гиперпаратиреоз при хронических заболеваниях почек
У пациентов с хроническими заболеваниями почек нарушенный синтез гормонально-активного витамина D в сочетании с длительной гиперкальциемией и повышенным уровнем фосфатов приводит к вторичному гиперпаратиреозу, одному из наиболее частых и тяжелых осложнений (около 30% пациентов, находящихся на программном гемодиализе) [12]. Это состояние, характеризующееся компенсаторной гиперсекрецией паратиреоидного гормона, приводит как к морфологическим изменениям паращитовидных желез, так и к развитию фиброзного остеита, потере костной массы и к сопутствующим сердечно-сосудистым заболеваниям [20]. Как правило, уровни паратиреоидного гормона в крови начинают повышаться при уменьшении скорости клубочковой фильтрации ниже 60 мл/мин/1,73 м2 [22]. К настоящему времени вопрос о времени появления у пациентов с хроническими заболеваниями почек сопутствующих сердечно-сосудистых заболеваний, их каузальной связи с дисфункцией паращитовидных желез и возможности обратного развития на фоне патогенетического лечения вторичного гиперпаратиреоза до конца не ясен [2, 3].
Давно известно, что паратиреоидный гормон оказывает воздействие на функционирование многих органов и систем [3]. При уремии, выделяясь в супрафизиологических концентрациях, он приобретает черты «универсального уремического токсина», вызывая плейотропную органную дисфункцию. Гиперсекреция паратиреоидного гормона способствует развитию ренальной остеодистрофии, уремической кардиомиопатии, «кальцификации миокарда», клапанов сердца и его проводящей системы, диффузному фиброзу миокарда, внескелетной кальцификации, артериальной гипертензии, ускорению развития атеросклероза, генерализованной васкулопатии, энцефалопатии; влияет практически на все стадии гемопоэза; нарушает секрецию инсулина [3, 15, 17, 20, 25, 31]. Эти события неразрывно связаны (по крайней мере, частично) с избыточной концентрацией паратиреоидного гормона и плохо корригируются заместительной почечной терапией.
Вторичная гиперплазия паращитовидных желез с повышением уровня паратиреоидного гормона в крови развивается практически у всех больных с хроническими заболеваниями почек. Вторичный гиперпаратиреоз у больных с хроническими заболеваниями почек — это компенсаторная гиперфункция паращитовидных желез, исходно направленная на поддержание физиологических параметров минерального и костного обмена, приводящая при прогрессировании почечной недостаточности к необратимым морфологическим изменениям (гипертрофии и гиперплазии главных клеток) паращитовидных желез [3].
Таким образом, своевременная диагностика, профилактика и адекватное лечение вторичного гиперпаратиреоза чрезвычайно важны для повышения качества и продолжительности жизни пациентов с хроническими заболеваниями почек.
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек
Патогенез вторичного гиперпаратиреоза при хронических заболеваниях почек до конца не ясен и продолжает уточняться. В развитии вторичного гиперпаратиреоза играют роль разнообразные факторы, что приводит к запуску целого каскада биохимических и патофизиологических изменений, приводящих к необратимым морфологическим изменениям паращитовидных желез [2, 3, 22, 23]: транзиторная и/или персистирующая гиперфосфатемия (ретенция фосфатов); резистентность рецепторов органов-мишеней к паратиреоидному гормону; изменение метаболизма витамина D.
На сегодняшний день в целом остается верной гипотеза Bricker N.?S. (1972), в основу которой были положены представления о том, что при хронической почечной недостаточности главным стимулом к развитию вторичного гиперпаратиреоза является гипокальциемия, которая возникает в ответ на гиперфосфатемию, связанную с ретенцией фосфатов [7, 8]. При хронической почечной недостаточности, особенно в терминальной ее стадии, происходит патологическая фенотипическая модуляция рецепторов (в т. ч. из-за изменения молекулярной структуры и их количества) к ионизированному кальцию на поверхности клеток паращитовидной железы и других органов-мишеней (кость, кишечник, сосуды и прочее), что кардинально изменяет гомеостаз кальция. В результате происходит сдвиг секреторной set-point и клетки паращитовидных желез начинают высвобождать паратиреоидный гормон в ответ не только на низкую, но и на нормальную концентрацию ионизированного кальция в крови больного [5, 9]. Снижение концентрации в крови 1,25-дигидроксихолекальциферола и увеличение концентрации фосфатов также являются прямыми стимуляторами синтеза паратиреоидного гормона [7, 8].
Эти представления легли в основу широкого клинического применения у пациентов, находящихся на заместительной почечной терапии, гипофосфатной диеты, фосфат-связывающих препаратов и кальцитриола. В результате удалось добиться более благоприятного течения ренальных остеодистрофий. Однако это не уменьшило остроту проблемы вторичного гиперпаратиреоза и связанных с ним осложнений со стороны сердечно-сосудистой системы.
Современные стандартные подходы к лечению вторичного гиперпаратиреоза при хронических заболеваниях почек
Современная (стандартная) терапия нарушений минерального обмена и связанных с ним осложнений включает диетические рекомендации по ограничению приема фосфатов, прием аналогов витамина D и фосфат-связывающих препаратов. Это в ряде случаев позволяет контролировать показатели фосфорно-кальциевого обмена и уровень паратиреоидного гормона в пределах целевых значений, установленных K/DOQI [22]. Целью терапии вторичного гиперпаратиреоза является снижение четырех лабораторных показателей: уровня паратиреоидного гормона, кальция и фосфора в сыворотке крови, а также фосфорно-кальциевого произведения (табл. 1).
![Целевые значения паратиреоидного гормона и показателей фосфорно-кальциевого обмена [22] Целевые значения паратиреоидного гормона и показателей фосфорно-кальциевого обмена [22]](http://www.osp.ru/data/2010/02/27/1227190214/71.jpg)
Cтандартная терапия нарушений минерального и костного обмена по данным литературы более чем в половине случаев не позволяет достичь необходимого клинического эффекта, а в некоторых ситуациях даже противопоказана [20].
Так, лишь 47,5% пациентов, находящихся на программном гемодиализе, соблюдают диету, направленную на ограничение фосфатов, при этом уровень фосфора и кальция сыворотки у этой группы больных не имеет достоверных различий по сравнению с пациентами, не соблюдающими диету. Кроме того, содержание фосфора в различных диетах, назначаемых пациентам, варьирует от 550 до 1000 мг/сутки (18–36 ммоль/сутки), что затрудняет контроль количества поступающих с пищей фосфатов [2].
Адекватный гемодиализ также не всегда позволяет справиться с нарушениями минерального обмена. Известно, что современная гемодиализная терапия позволяет удалять лишь лимитированное количество фосфатов: от 20 до 40 ммоль за сеанс, что за неделю составляет 60–120 ммоль [24]. Более того, риск развития тяжелых форм гиперпаратиреоза (и, как следствие,?— относительный риск смерти) у таких больных прямо пропорционален продолжительности нахождения на гемодиализе (смертность в этой группе больных составляет 44% за 4 года) [1]. Эффективным является увеличение диализного клиренса фосфатов с использованием ежедневного дневного или ночного гемодиализа, гемодиафильтрации [11]. Однако такой подход неприменим в широкой клинической практике.
Эффективность терапии активными формами витамина D, например кальцитриолом, также зачастую не оправдывает ожиданий. Применение этой группы препаратов ограничено, во-первых, из-за исходной или развивающейся на фоне лечения резистентности, что требует назначения их в дозах, превышающих физиологические. Во-вторых, имея относительно узкое «терапевтическое окно» и усиливая всасывание кальция и фосфора в желудочно-кишечном тракте, они приводят к гиперкальциемии, усугубляют гиперфосфатемию и увеличивают фосфорно-кальциевое произведение [28]. Предполагаемые механизмы резистентности к лечению активированными аналогами витамина D при хронической почечной недостаточности включают в себя: опосредованные уремией снижение транспорта кальцитриола в паращитовидные железы; снижение образования комплекса кальцитриол–рецепторы к витамину D; снижение содержания функциональных рецепторов к витамину D в ткани паращитовидных желез [12]. Парикальцитол (Земплар) — синтетический селективный активатор рецепторов витамина D.
Подобные парикальцитолу модифицированные аналоги витамина D имеют меньший кальциемический эффект и, соответственно, более широкое терапевтическое окно [12, 19]. Кроме того, они быстрее, чем кальцитриол, подавляют секрецию паратиреоидного гормона и приводят к менее выраженному увеличению концентрации кальция и фосфора в сыворотке [27]. Парикальцитол сохраняет свою способность снижать паратиреоидный гормон у пациентов с гиперфосфатемией или с устойчивостью к терапии кальцитриолом [18].
Традиционное применение кальциевых фосфат-биндеров позволяет в ряде случаев корригировать гиперфосфатемию и гипокальциемию. Однако эта группа препаратов позволяет абсорбировать не более 50% потребляемого фосфора [16]. Кроме того, как любой другой препарат, фосфат-биндеры не лишены побочных эффектов: гиперкальциемия за счет всасывания кальция; связывание в кишечнике железа наряду с фосфатом; желудочно-кишечные расстройства. Необходимо считаться с тем, что на стандартной диете (1–1,2 г/кг/сутки белка) эффективны только высокие дозы карбоната кальция (9–10 г/сутки). Длительное применение таких доз карбоната кальция в 60% случаев осложняется гиперкальциемией. В настоящее время созданы фосфат-биндеры на полимерной основе, не содержащие ни алюминия, ни кальция и не всасывающиеся в кишечнике: севеламера гидрохлорид (RenaGel), севеламера карбонат (Renvela), Genzyme, Ирландия. Основное различие между ними состоит в том, что последний не вызывает метаболического ацидоза и таким образом не способствует прогрессированию костной болезни. Однако опыта применения этой группы препаратов в России пока нет [2].
В качестве крайней меры пациентам с осложненными формами вторичного гиперпаратиреоза применяется оперативное лечение, которое, к сожалению, подчас также оказывается неэффективным [2].
Указанные трудности в лечении нарушений минерального и костного обмена у больных с хроническими болезнями почек способствовали разработке и внедрению в клиническую практику принципиально новой группы препаратов — кальцимиметиков, изменяющих чувствительность рецепторов паращитовидных желез. Цинакалцет (Код АТХ: Н05ВХ01) производится международной биотехнологической компанией AMGEN (США) и зарегистрирован в Северной Америке под торговым названием Сенсипар, а в Европе — Мимпара.
В России препарат появился относительно недавно, поэтому достаточный опыт его практического применения еще не накоплен. За рубежом цинакалцет активно применяется с 2004 года более чем в 34 странах и хорошо зарекомендовал себя не только с клинической, но и с экономической точки зрения, позволяя заметно снизить затраты на лечение тяжелых осложнений хронических заболеваний почек.
Цинакалцет обладает прямым кальцимиметическим действием, непосредственно снижающим уровень паратиреоидного гормона, повышая чувствительность рецептора к внеклеточному кальцию. Снижение уровня паратиреоидного гормона коррелирует с концентрацией цинакалцета в крови. После перорального приема цинакалцета его максимальная концентрация в плазме крови достигается примерно через 2–6 часов, что сопровождается максимальным снижением уровня паратиреоидного гормона в крови. После этого концентрация цинакалцета начинает снижаться, а уровень паратиреоидного гормона повышается в течение 12 часов после введения дозы, в последующем супрессия паратиреоидного гормона остается примерно на одном и том же уровне до конца суточного интервала при режиме дозирования один раз в день. Примерно 80% вводимой дозы цинакалцета выводится почками, 15% — через желудочно-кишечный тракт. Снижение концентрации цинакалцета происходит в два этапа: первоначальный период полувыведения составляет примерно 6 часов, окончательный — от 30 до 40 часов. Стабильное содержание препарата достигается в течение 7 дней с минимальной кумуляцией. После достижения стабильной фазы концентрация кальция в сыворотке крови остается на постоянном уровне в течение всего интервала между приемами препарата. По данным литературы цинакалцет позволяет существенно снизить уровень паратиреоидного гормона уже к концу второй недели лечения.
В качестве иллюстрации вышесказанному приводится следующий клинический пример:
Больная Х., 64 года, с декабря 2005 года находится на лечении программным гемодиализом (в ГВКГ им. Н.?Н.?Бурденко с апреля 2007 года) по поводу терминальной почечной недостаточности в исходе диабетической нефропатии в сочетании с хроническим пиелонефритом. С 1965 года диагностируется алиментарно-конституциональное ожирение 2–3 степени, с 1996 года — сахарный диабет 2-го типа средней тяжести, а затем — тяжелого течения. С 1998 года — ишемическая болезнь сердца: клиника нагрузочной стенокардии отсутствовала, диагноз верифицирован на основании признаков «безболевой ишемии» миокарда и AV-блокады I степени по данным суточного мониторирования электрокардиограммы. Примерно с того же времени повышение уровня артериального давления (АД) до 220 и 140 мм рт. ст., адаптирована к АД 160/100 мм рт. ст. Постоянная четырехкомпонентная гипотензивная терапия в составе: Альбарел 2 мг/сутки, Амловас 20 мг/сутки, Аккупро 20 мг/сутки, Эгилок 100 мг/сутки — позволяла поддерживать целевой уровень АД (не свыше 140/90 мм рт. ст.) до 2005 года. С целью профилактики атеросклеротических осложнений постоянно принимала статины в суточной дозе 10 мг.
С начала 2005 года присоединяются клинико-лабораторные и инструментальные признаки прогрессирования атеросклероза, «озлокачествления» гипертензивного синдрома: в январе 2005 года появляется микроальбуминурия, которая уже в марте сменяется протеинурией до 1,5 г/сутки; несмотря на регулярный прием рекомендованных гипотензивных препаратов развивается лабильность АД. В связи с этим по рекомендации врачей поликлиники при ситуационном повышении АД свыше 160/100 мм рт. ст. (до двух-трех раз в неделю) принимала дополнительно Кордафлекс 40 мг/сутки. По данным визуализирующих методов исследования (эхокардиографии, рентгенографии органов грудной клетки) определяется достаточно быстрое увеличение массы миокарда (исходно 345 г, в последующем 436 г) с появлением признаков диастолической дисфункции первого типа и клинических симптомов хронической сердечной недостаточности на уровне функциональной классификации (ФК) II, метастатической кальцификации мягких тканей, крупных сосудов и створок аортального клапана (атеросклеротический стеноз устья аорты), что в тот период времени трактовалось как следствие особенно тяжелого течения атеросклероза, и в связи с этим увеличивается суточная доза статинов до 20 мг.
В декабре 2005 года на фоне роста азотемии (креатинин сыворотки крови 780 мкмоль/л) в результате обострения пиелонефрита, присоединения пневмонии у больной диагностируется терминальная стадия хронической почечной недостаточности и начинается лечение программным гемодиализом (3 раза в неделю по 4 часа), проведение которого вначале сопровождалось усугублением тяжести гипертензивного синдрома (АД до 240/140 мм рт. ст.). В марте 2006 и феврале 2007 года на фоне плохо поддающейся коррекции артериальной гипертензии переносит повторные острые нарушения мозгового кровообращения в бассейне левой среднемозговой артерии с исходом в правосторонний гемипарез и сенсорно-моторную афазию. В апреле 2007 года для продолжения лечения переводится в ГВКГ им. Н.?Н.?Бурденко.
В этот период у больной сохраняется выраженная артериальная гипертензия (180–200/80–90 мм рт. ст.), резистентная к стандартной ультрафильтрации и вышеуказанной медикаментозной терапии. Проведение гемодиализа с ультрафильтрацией в ежедневном режиме в течение 6 дней в неделю позволило снизить «сухой вес» на 6 кг, что сопровождалось стабилизацией АД на уровне 160/90 мм рт. ст. Концентрация фосфора в сыворотке крови составляла 2,51 ммоль/л, кальция — 2,62 ммоль/л (фосфорно-кальциевое произведение = 6,58 ммоль2/л2), уровень паратиреоидного гормона — 24,8 пг/мл. Учитывая «высокое» фосфорно-кальциевое произведение и нормальное содержание паратиреоидного гормона, медикаментозная терапия не назначалась, больной рекомендовалась гипофосфатная диета и прием карбоната кальция (до 3 г в сутки), однако соблюдение диетических правил оказалось невозможным из-за двигательных расстройств (правосторонняя гемиплегия) и низкого комплаенса (дисциркуляторная энцефалопатия с выраженными когнитивными расстройствами). Это в течение трех месяцев привело к усугублению гиперфосфатемии и гиперкальциемии (3,0 ммоль/л и 2,7 ммоль/л соответственно).
Несмотря на почти полное обездвиживание больной, предрасполагающее к развитию адинамической болезни кости, появляются лабораторные и клинические признаки гиперпаратиреоза: увеличение уровня паратиреоидного гормона до 488 пг/мл, присоединение нестерпимого кожного зуда. Ультразвуковое исследование паращитовидных желез не выявило аденоматозных изменений. Высокий уровень фосфора сделал невозможным назначение активированных аналогов витамина D. Было принято решение об изменении диализной программы с увеличением времени диализа до 15 часов в неделю и добавлением к стандартному гемодиализу еженедельно проводимой гемодиафильтрации (конвекционный клиренс — 21 литр в неделю), использовались также индивидуальные диализаторы с мембраной повышенной сорбционной активности (полиметилметакрилат) с достижением недельного Kt/V до 3,75. Это позволило приостановить прогрессирование клинических и лабораторных признаков гиперпаратиреоза (уровень паратиреоидного гормона к декабрю 2008 года составлял 504 пг/мл), выраженность кожного зуда уменьшилась, однако уровень фосфора и кальция по-прежнему оставался высоким (фосфорно-кальциевое произведение > 8,2 ммоль2/л2). Когда все методы современной терапии нарушений фосфорно-кальциевого и костного обмена были исчерпаны, нами был назначен цинакалцет (декабрь 2008 года) в стартовой дозе 30 мг/сутки.
В дальнейшем контроль показателей фосфорно-кальциевого обмена и уровня паратиреоидного гормона осуществлялся один раз в месяц. С целью оценки возможного влияния цинакалцета на уровень АД, функцию сердечной мышцы ежемесячно выполнялись трансторакальная эхокардиография, суточное мониторирование АД и ЭКГ. Оценка нарушений диастолической функции левого желудочка сердца выполнялась по общепринятым критериям [10, 13, 14]. Ежедневно контролировались масса тела, уровень АД и частота сердечных сокращений (ЧСС) (утром и вечером).
Динамический контроль за указанными параметрами показал, что через 2 недели лечения у больной Х. стойко снизился уровень как систолического, так и диастолического АД (со 160/90 мм рт. ст. до 140/80 мм рт. ст.), уменьшилась ЧСС (с 90 до 78 ударов в минуту), что подтверждалось данными СМАД и ХМЭКГ в январе 2009 года. Снижение АД и урежение ЧСС позволило откорректировать в сторону уменьшения состав гипотензивной терапии: постепенно были полностью отменены Эгилок и Кордафлекс. Уровни паратиреоидного гормона, кальция и фосфора крови оставались прежними. Поскольку в «Инструкции по применению цинакалцета» заявлено, что транзиторное снижение паратиреоидного гормона начинается через 6 часов после приема первой дозы, а стойкое — через 7 дней лечения, отсутствие эффекта через месяц приема препарата у нашей больной было расценено как следствие недостаточной начальной дозы, в связи с чем она была увеличена до 60 мг/сутки (2 таблетки). Однако появление через два дня стойкой тошноты заставило нас вернуться к исходной дозе цинакалцета 30 мг в сутки. Начальное снижение уровня паратиреоидного гормона до 345 пг/мл отмечено лишь в феврале 2009 года — на третьем месяце лечения цинакалцетом в дозе 30 мг/сутки. Еще через месяц начали снижаться уровни кальция, фосфора в крови и фосфорно-кальциевое произведение. Прием цинакалцета в той же дозе в монотонном режиме в течение четырех месяцев позволил практически нормализовать концентрацию кальция и фосфора сыворотки крови (соответственно 2,06 и 2,24 ммоль/л) к июлю 2009 года, а также снизить активность паратиреоидного гормона до 155 пг/мл.
Исходно масса миокарда была повышена до 436 г за счет концентрической гипертрофии и в последующем не изменилась, однако через три месяца лечения цинакалцетом улучшились эхокардиографические показатели функционального состояния сердечной мышцы. Если в начале периода наблюдения имелись все признаки диастолической дисфункции первого типа, характеризующейся нарушением релаксации левого желудочка (аномальная релаксация) и патогенетически связанной с гипертрофией левого желудочка, повышенным уровнем артериального давления и паратиреоидного гормона, то через три месяца лечения цинакалцетом они регрессировали (табл. 2). Незначительно увеличилась фракция изгнания левого желудочка.
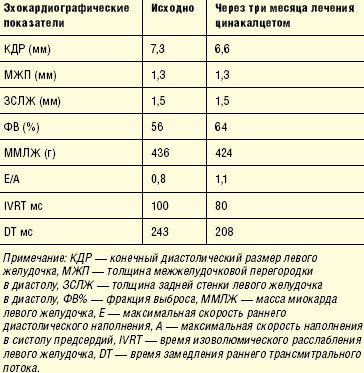
Обсуждение
Таким образом, только комплексный подход к лечению нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза с включением в фармакологическую комбинацию кальцимиметиков (цинакалцет) у больной, находящейся на заместительной почечной терапии, позволил поддерживать целевые уровни фосфорно-кальциевого обмена и паратиреоидного гормона, рекомендованные K/DOQI.
В приведенном клиническом случае традиционные подходы к коррекции минерального и костного обмена и связанного с ними вторичного гиперпаратиреоза у больной с терминальной стадией хронической почечной недостаточности, находящейся на гемодиализе, оказались неэффективными, как нам видится, по следующим причинам: невозможность соблюдения гипофосфатемической диеты и приема фосфат-биндеров (карбоната кальция) пациенткой с интеллектуально-мнестическими и двигательными расстройствами; назначение аналогов активированного витамина D (кальцитриол) было ограничено гиперкальциемией.
Дополнение комплексного лечения нарушений минерального обмена цинакалцетом позволило в течение трех месяцев достичь целевых значений минерального обмена и уровня паратиреоидного гормона. Преимуществом цинакалцета в данном случае мы считаем, помимо его очевидной эффективности в отношении гиперфункции паращитовидных желез и минерального обмена, возможность точного дозирования и однократного приема в течение суток.
Более спокойное течение артериальной гипертензии на наш взгляд явилось следствием комплекса причин: сыграли свою роль устранение гипергидратации (исходная масса тела составляла 90 кг, в последующем — 84 кг), успешная коррекции фосфорно-кальциевого обмена и снижение уровня паратиреоидного гормона. Учитывая относительно быстрое достижение нормотензии без увеличения количества и суточной дозировки антигипертензивных препаратов, нельзя исключать непосредственный гипотензивный эффект цинакалцета. Экспериментально были установлены как прямой, так и опосредованный повышенной продукцией NO вазодилятирующий эффект цинакалцета [26], а также его ингибирующее влияние на выработку ренина юкстагломерулярным аппаратом почек [23].
Диспептический синдром в виде тошноты и тяжести в эпигастрии, развившийся на следующий день после увеличения вдвое (до 60 мг) суточной дозы цинакалцета, регрессировал после возвращения к исходной дозе 30 мг так же быстро, как и развился, что не потребовало отмены препарата. Лабораторно-инструментальное обследование (фиброгастродуоденоскопия, ультразвуковое исследование органов брюшной полости, биохимическое тестирование общей и панкератической амилазы в крови и диастазы в моче) не выявило какой-либо патологии со стороны дуоденохоледохопанкреатической зоны, что позволило нам рассматривать развитие данного симптомокомплекса в рамках побочного действия цинакалцета и сделать предварительный вывод о хорошей переносимости препарата. По результатам контролируемых клинических исследований (данные о 656 больных, принимавших цинакалцет, и о 470 больных, принимавших плацебо) наиболее часто встречающимися побочными эффектами были тошнота и рвота, которые отмечались у 31% больных в группе терапии цинакалцетом и у 19% больных в группе плацебо, а также у 27% больных в группе терапии цинакалцетом и у 15% в группе плацебо. Тошнота и рвота были легкой и умеренной степени выраженности и в большинстве случаев носили кратковременный характер. Прекращение терапии в результате развития нежелательных эффектов было вызвано главным образом тошнотой (5%) и рвотой (4%).
Причиной нарушения диастолической функции левого желудочка у больной Х. на наш взгляд являлась концентрическая гипертрофия миокарда, как один из наиболее часто встречающихся вариантов ремоделирования левого желудочка у больных, длительно страдающих артериальной гипертензией и сахарным диабетом. Через три месяца приема цинакалцета стали регрессировать клинические симптомы хронической сердечной недостаточности и эхокардиографические признаки диастолической дисфункции, что более вероятно обусловлено как снижением АД до целевого уровня, так и устранением кардиотоксического действия супрафизиологических коцентраций паратиреоидного гормона. Сыграла свою роль и отмена бета-блокаторов, что стало возможным после назначения цинакалцета, поскольку эта группа препаратов негативно влияет на податливость миокарда. К сожалению, четких рекомендаций и схем терапии больных с диастолической хронической сердечной недостаточностью в настоящее время не существует. Европейское общество кардиологов (ESC) в 1997 г. опубликовало лишь общие направления терапии хронической сердечной недостаточности у больных с диастолической дисфункцией [29]. Поэтому любой положительный опыт лечения нарушений диастолической функции левого желудочка должен тщательно анализироваться.
Кроме того, минимальная эффективная поддерживающая доза цинакалцета 30 мг/сутки, что соответствует 1 упаковке (28 таблеток) на месяц, позволяет говорить о приемлемом фармакоэкономическом профиле препарата.
Таким образом, первый опыт применения цинакалцета при вторичном гиперпаратиреозе у пациентки с терминальной стадией хронической почечной недостаточности, находящейся на программном гемодиализе, оказался более чем положительным. Конечно, для выявления корреляции между снижением уровня паратиреоидного гормона и улучшением течения сердечно-сосудистой патологии необходимо накопить достаточный клинический опыт. Последующие исследования могут подтвердить или опровергнуть данное утверждение.
Литература
-
Бикбов Б.?Т., Томилина Н.?А. О состоянии заместительной терапии больных с хронической почечной недостаточностью в Российской Федерации в 2001 г. // Нефрология и диализ. 2004; 6; 1: 4–46.
-
Гранкин В.?И., Новосельцев И.?Л., Новицкий Л.?В., Хорошилов С.?Е. Диагностика и лечение нарушений фосфорно-кальциевого обмена и вторичного гиперпаратиреоза у больных с терминальной почечной недостаточностью: Методические указания. М.: ГВКГ им. Н.?Н.?Бурденко. 2005. 25 с.
-
Ермоленко В.?М. Фосфорно-кальциевый обмен и почки // Нефрология: Руководство для врачей. Под ред. И.?Е.?Тареевой. М.: Медицина, 2000, с. 62–75.
-
Земченков А.?Ю., Томилина Н.?А. «К/ДОКИ» обращается к истокам хронической почечной недостаточности (О новом разделе Рекомендаций K/DOQI по диагностике, классификации и оценке тяжести хронических заболеваний почек) // Нефрология и диализ. 2004. № 3 (т. 6). 204. 220 с.
-
Новиков А.?И. Современный взгляд на патогенез гиперпаратиреоза при почечной недостаточности как на проблему роста отдельных клонов паращитовидной железы // Практическая нефрология. 1998; 2: 27–36.
-
Шутов Е.?В. Нутритивный статус у больных с хронической почечной недостаточностью // Нефрология и диализ. 2008. № 3–4 (т. 10). С. 199–207.
-
Bricker N.?S. On the pathogenesis of the uremic state. An exposition of the «Trade-off hypothesis» // N.?Engl. J.?Med. 1972; 286; 1093–1099.
-
Bricker N.?S., Orden D.?A., Schreiner G.?C., Wasler M. Invited discussion // Arch. Internal Med. 1969; 124; 3: 271–288.
-
Brown E.?M. Mechanism underlying the regulation of the parathyroid hormone secretion in vivo and in vitro // Curr. Opinion. Nephrol. Hypertension. 1993; 2: 541–551.
-
Cohen G.?I., Pietrolungo J.?F., Thomas J.?D., Klein A.?L. A practical guide to assessment of ventricular diastolic function using Doppler echocardiography // J Am Coll Cardiol. 1996; 27: 1753–1760.
-
Drueke T.?B. Foreword: Extraskeletal calcification in patients with chronic renal failure // Nephrol. Dial. Transplant. 2002; 17: 330–331.
-
Dusso A.?S., Thadhani R., Slatopolsky E. Vitamin D receptor and analogs // Semin Nephrol. 2004; 24 (1): 10–16.
-
Farias C., Rodriges L., Garcia M. et al. Assessment of diastolic function by tissue doppler echocardiography: comparison with standard transmitral and pulmonary venous flow // J Am Soc Echocardiogr. 1999, 12, 609–617.
-
Garcia M., Palac R., Malenka D. et al. Color M-mode flow propagation velocity is a relatively preload-independent index of left ventricular filling // J Am Soc Echocardiogr. 1999, 12: 129–137.
-
Goodman W.?G., Goldin J., Kuizon B.?D. Coronary-artery calcification in young adults with end-stage renal disease who are undergouing dialysis // N Engl J Med. May 18?2000; 342 (20): 1478–1483.
-
Janssen M.J.A.,van der Kuy A.,Ter Wee P.M.,Van Boven W.L.P.Aluminum hydroxide, calcium carbonate and calcium acetate in chronic intermittent hemodialysis patients //Clin Nephrol.1996.Vol.45.P.111-119.
-
Levin A., Bakris G.?L., Molitch M. Prevalence of abnormal serum vitamin D, PTH, calcium, and phosphorus in patients with chronic kidney disease: results of the study to evaluate early kidney disease // Kidney Int. 2007, Jan; 71 (1): 31–38.
-
Lindberg J., Martin K.?J., Gonzales E.?A. A long-term, multicenter study of the efficacy and safety of paricalcitol in the end-stage renal disease // Clin Nephrol. Oct; 56 (4): 315–323.
-
Llach F., Yudd M. Paricalcitol in dialysis patients with end-stage renal disease: A century-old phenomenen // Kidney Int Suppl. 2002, Dec. (82): 73–80.
-
Martin K.?J., Gonzalez E.?A. Vitamin D analogs: actions and role in the treatment of secondary hyperparathyroidism // Semin Nephrol. 2004; 24 (5): 456–459.
-
Miyamoto K., Tatsumi S., Segawa H. et al. Regulation of PiT-1, a sodium-dependent phosphate co-transporter in rat parathyroid glands // Nephrol Dial Transplant. 1999; 14 (Suppl 1): 73–75.
-
National Kidney Foundation. K/DOQI Clinical Practice Guidelines for Bone Metabolism and Disease in Chronic Kidney Disease // Am J Kidney Dis. 2003. 42 (suppl 3). C. 1–202.
-
Ortiz-Capisano M.?C., Ortiz P.?A., Garvin J.?L. Expression and functional calcium-sensing receptor in juxtaglomerular cells // Hypertension. 2007; 50 (4): 737–743.
-
Pogglitsch H., Petek W., Ziak E., Sterz F., Holzer H. Phosphorus kinetics during haemodialysis and haemodiaviltration // Proc EDTA-ERA. 1984. Vol. 21. P. 461–468.
-
Qunibi W.?Y., Goldin J., Kuizon B.?D. Coronary calcification in patients with end-stage renal disease: A century-old phenomenon // Kidney Int Suppl. 2002, Dec. (82): 73–80.
-
Smajilovic S., Sheykhzade M., Holmegard H.?M. Calcimimetic, AMG 073, induces relaxation on isolated rat aorta // Vascul Pharmacol. 2007; 47 (4): 222–228.
-
Sprague S.?M., Llach F., Amdahl M. Paricalcitol versus calcitriol in the treatment of secondary hyperparathyroidism // Kidney Int. 2003; 63 (4): 1483–1490.
-
Teng M., Wolf M., Ofsthum M.?N. Activated Injectable Vitamin D and Hemodialysis Survival: A Historical Cohort Study 10.1681/ASN.2004070573 // J Am Soc Nephrol. April 1, 2005; 16 (4): 1115–1125.
-
The treatment of heart failure. The Task Force of Working Group on Heart Failure of European Society of Cardiology // Eur Heart J. 1997; 18: 736–753.
-
U.?S.?Renal Data System: USRDS 2002 Annual Data Report. Bethesda, MD, National Institutes of Health, National Institute of Diabetes and Digestive and Kidney Diseases, 2002.
-
Wu-Wong J.?R., Tian J., Nakane M. Cardiovascular disease in chronic kidney failure: the role VDR activators // Curr Opin Investig Drugs. 2006; 7 (3): 2006–213.
С. Е. Хорошилов, доктор медицинских наук
А. В. Никитин, кандидат медицинских наук
Т. Ю. Очеченко
ФГУ «ГВКГ им. академика Н. Н. Бурденко МО РФ», Москва
Контактная информация об авторах для переписки: aniki2005@mail.ru
Купить номер с этой статьей в pdf









