
Тема урока
Алканы
Автор: учитель химии Морозова Т.В

План .
- Общая характеристика алканов.
- Строение, изомерия, номенклатура.
- Способы получения .
- Физические свойства .
- Химические свойства .
- Применение .

Общая характеристика алканов
- Алканы (предельные углеводороды) – углеводороды, в молекулах которых атомы связаны одинарными связями.
- Общая формула: С n Н 2n+2
- Орбитали находятся в sp3- гибридизации.
- Все связи одинарные!!!
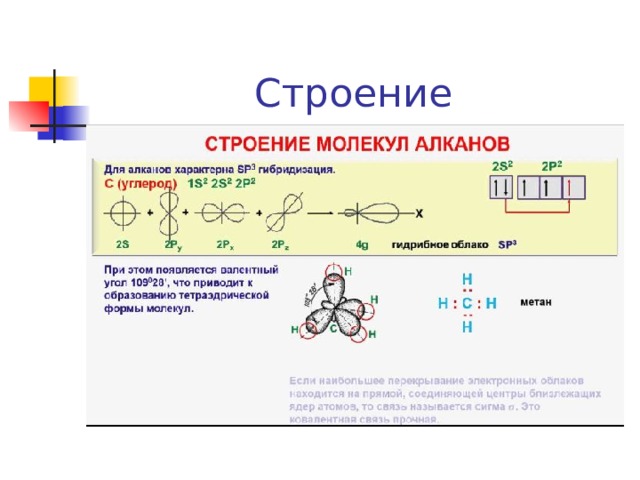
Строение

Изомерия и номенклатура

Получение
В лаборатории :
1) Реакция Вюрца :
2 C 2 H 5 Cl + 2Na → C 4 H 10 + 2NaCl
2) Сплавление ацетата натрия с твердым гидроксидом натрия (реакция Дюма) :
СН 3 СОО Na + Na ОН → СН 4 ↑ + N а 2 СО 3

Получение
3) Каталитическое гидрирование непредельных углеводородов ( kat, t, p)
R-CH=CH-R + H2 → R-CH2-CH2-R
CH2=H2C + H2 →
4) Гидролиз карбида алюминия (получение СН4)
Al4C3+12H2O→3CH4↑+4Al(OH)3
5) Синтез метана из простых веществ
С + 2Н2 →CH4↑

Получение
В промышленности
1) Из природного сырья – нефти, газа :
2) Реакция Фишера – Тропша ( kat, 300ºC) :
n СО + (2 n +1) Н 2 → С n Н 2n+2 + H 2 О

Физические свойства
СН 4 …C 4 Н 10 – газы
T кипения :
-161,6…-0,5 °C
T плавления :
-182,5…-138,3 °C
С 16 Н 3 4 … и далее– твёрдые вещества
T кипения :
287 ,5 °C
T плавления :
20 °C
С 5 Н 12 …C 15 Н 32 – жидкости
T кипения :
36 , 1 … 270 ,5 °C
T плавления :
-12 9 , 8 … 10 °C
С увеличением относительных молекулярных масс предельных углеводородов закономерно повышаются их температуры кипения и плавления.

Упражнения для закрепления!!!

Домашнее задание:
- Учебник : § 10 (стр. 69-76)
- Упражнение 2,5, стр.86

Химические свойства алканов
I ) Реакции замещения.
1. Галогенирование. Реакция происходит на свету
СН 4 + С l 2 → СН 3 С l + Н С l
хлорметан
СН 3 С l + С l 2 → СН 2 С l 2 + Н С l
дихлорметан
СН 2 С l 2 + С l 2 → СН С l 3 + Н С l
трихлорметан
СН С l 3 + С l 2 → С С l 4 + Н С l
тетрахлорметан

Механизм реакции замещения
1. Под действием света молекула С l 2 распадается на атомы:
С l С l
Механизм реакции замещения
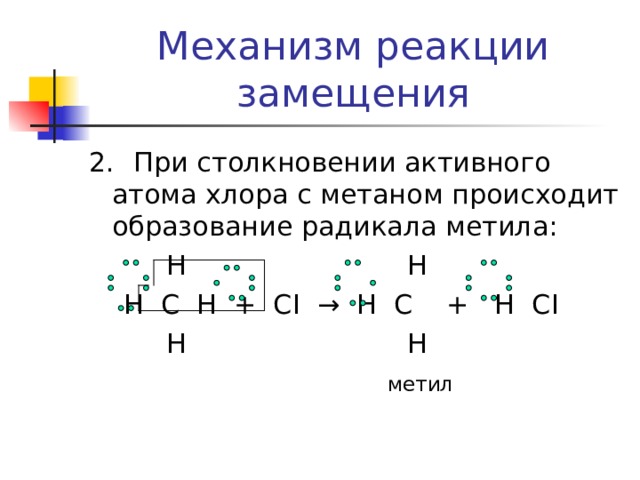
2. При столкновении активного атома хлора с метаном происходит образование радикала метила:
Н Н
Н С Н + С I → Н С + Н С I
Н Н
метил

Механизм реакции замещения
3. Далее метил реагирует со следующей молекулой хлора, таким образом образуя свободные атомы хлора, которые замещают следующий атом водорода уже в хлорметане и т.д.
Это цепная реакция – реакция, в которой происходит цепь последовательных превращений

Химические свойства алканов
2 . Реакция нитрования – реакция Коновалова ( t,p)
R-H + HO-NO 2 → R-NO 2 + H 2 O
CH 3 -CH 2 -CH 3 + HNO 3 →
3 . Дегидрирование ( 30 0 -350º С, Ni, Pt или С r 2 O 3 ) c образованием алкенов или циклоалканов:
СН 3 – СН 3 → Н 2 С=СН 2 + Н 2
С r 2 O 3 , 300 º С
С 6 Н 14 →

Химические свойства алканов
4 . Реформинг – изменение формы (характерна для гексана и его гомологов при 500 º С, Al 2 O 3 , 40 атм)
С 6 Н 14 → С 6 Н 6 + 4 H 2
CH 3 -CH 2 -CH 3 + HNO 3 →
5. Пиролиз метана
t = 1200 º С: СН 4 → С + 2Н 2
t = 1000 º С: 2СН 4 → Н-С≡С-Н + 3Н 2

Химические свойства алканов
II ) Реакции, протекающие с разрывом связи С-С.
1. Изомеризация ( AlCl 3 , t)
Бутан → Изобутан
2 . Крекинг (высокотемпературная переработка нефти и ее фракций с целью получения продуктов с меньшей молярной массой):
С 6 Н 14 → С 3 Н 8 + С 3 Н 6

Химические свойства алканов
III ) Реакции окисления (горения).
СН 4 + 2О 2 → СО 2 + 2Н 2 О + Q
С 2 Н 6 + О 2 →
С 3 Н 8 + О 2 →

Применение алканов
Широко
используются в
качестве
топлива, в том
числе для
двигателей
внутреннего
сгорания.

Применение алканов
1-3 – производство сажи
(1 – картриджи ;
2 – резина ;
3 – типографическая краска)
4-7 – получение
органических веществ
(4 – растворителей ;
5 – хладогентов ,
используемых
в холодильных установках ;
6 – метанол ;
7 - ацетилен)
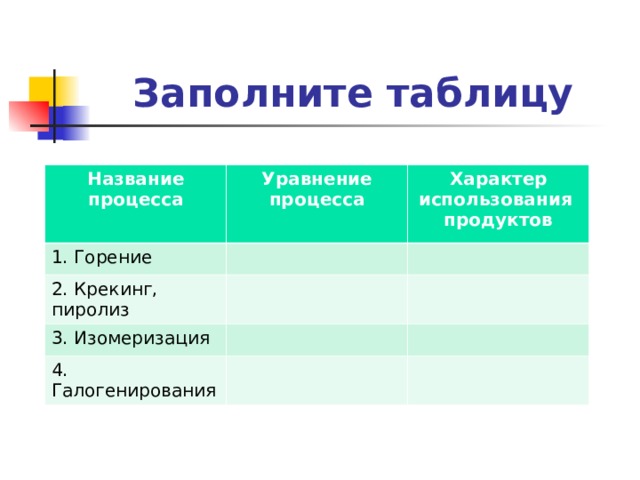
Заполните таблицу
Название процесса
Уравнение процесса
1. Горение
Характер использования продуктов
2. Крекинг, пиролиз
3. Изомеризация
4. Галогенирования

Домашнее задание:
- Учебник : § 10
- Закончить заполнение таблицы
- Упражнение 3,6, стр.86













































